En la búsqueda de alternativas a los combustibles fósiles, una de las opciones que más desarrollo está teniendo es el motor eléctrico. Sin embargo, también está como posibilidad el motor de hidrógeno. Las ventajas de este motor de hidrógeno son claras: no necesita pesadas baterías y su potencia y autonomía serían mayores. Pero, ¿cuál sería la mayor ventaja?... La contaminación nula. En principio, la contaminación producida sería nula ya que la combustión del hidrógeno produce energía y agua. Pero es importante remarcar que al hablar de contaminación nula hay que tener mucho cuidado. Es cierto que su combustión solo produce agua pero ¿qué ocurre hasta que hemos producido industrialmente ese hidrógeno?... Lo normal es que se produzcan deshechos y residuos, y por tanto, tengan que ser tratados como elementos contaminantes.
El hidrógeno es el elemento más abundante con diferencia del universo. Sin embargo, es tan ligero que la gravedad de la Tierra no es lo suficiente elevada como para retenerlo y escapa al espacio. Por ello, como solo existen trazas de él en la atmósfera la mayor parte del hidrógeno que se emplea como combustible hoy en día procede de los combustibles fósiles (petróleo y gas natural mayormente). Esta opción de obtención de hidrógeno es ecológicamente muy desfavorable. Otra opción más ecológica y sostenible de obtener hidrógeno es extraerlo termoquímicamente de la biomasa, usando altas temperaturas y catalizadores muy caros. Aunque existen alternativas como la fermentación, la electrolisis y la conversión fotoelectroquímica, estos métodos no pueden degradar las moléculas que forman la mayor parte en peso de la biomasa (lignina y celulosa) presentes en hierbas y maderas, con lo que la eficiencia para obtener el hidrógeno desaparece.
Sin embargo, un equipo de investigadores encabezado por Wei Liu, del Instituto de Tecnología de Georgia (EE.UU.), han presentado una tecnología electrolítica que puede extraer hidrógeno a partir de casi cualquier tipo de biomasa.
El proceso tiene lugar en una cuba eletrolítica que contiene una membrana, que los protones (átomos de hidrógeno que han perdido un electrón) pueden atravesar, colocada entre dos placas que son el ánodo y el cátodo. Una dispersión en agua de biomasa en polvo y un catalizador (polioxometalato o POM) se añaden a la parte del ánodo de la cuba. Calentando esta mezcla o, simplemente exponiéndola al sol, las moléculas de POM se encargan de arrancar átomos de hidrógeno de la biomasa, convirtiéndose en H-POM. Si ahora se aplica un voltaje entre los electrodos, las moléculas H-POM dejan un electrón en el ánodo cargado y "abandonan" el protón en el agua. Los electrones fluyen por el circuito hasta el cátodo de la cuba, donde los protones solitarios han llegado atravesando la membrana (son los únicos que pueden atravesarla) . Protones y electrones se combinan en el cátodo, formando átomos de hidrógeno, que reaccionan entre sí rápidamente para formar hidrógeno molecular que puede ser recogido y almacenado.
Esquema del proceso descrito
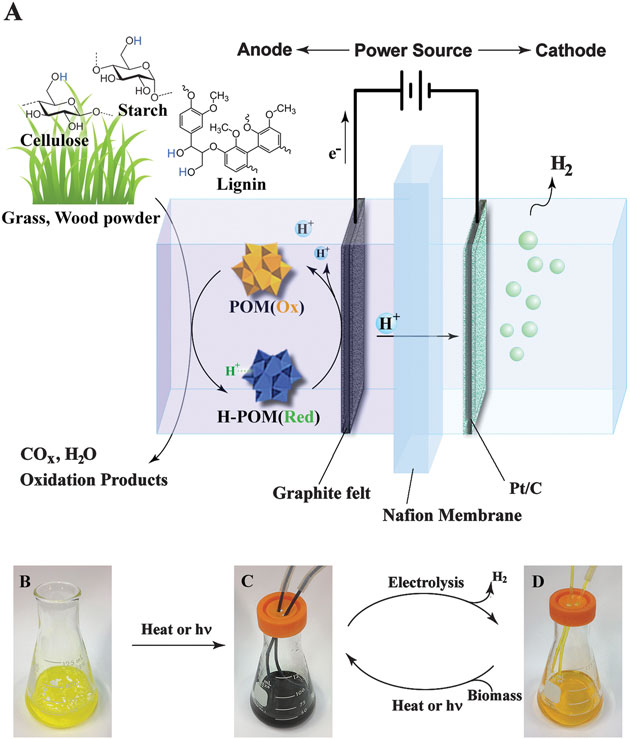
Este nuevo proceso de obtener hidrógeno, abre la puerta a la producción de hidrógeno ajustándolo a la cantidad y variedad de biomasa disponible. Esto implica la posibilidad de producir localmente hidrógeno en pequeñas instalaciones con biomasa disponible para un consumo también local. El grupo de investigación sigue trabajando para aumentar el rendimiento del proceso y se plantean la posibilidad de construir la primera planta piloto. Todo parece indicar que estos estudios están pensados para pequeñas plantas productoras de hidrógeno. ¿Autoconsumo?... ¿Independencia energética?... Todos recordamos lo que ha ocurrido en España con los pequeños productores de energía solar. Al principio todo era maravilloso y luego... un infierno para los pequeños productores que se subieron al carro... como algunos lo han calificado: Una estafa estatal en toda regla. Hablan de potenciar las energías renovables y limpias (aunque yo prefiero decir no tan sucias) pero todo se ha quedado en palabras y en recaudar dinero...
Durante el curso 2014/15 dentro de la materia Taller de Ciencias de 1º ESO trabajamos las reacciones químicas, y dentro de ellas, la reacción entre ácidos y metales. Comparamos la reacción entre el ácido clorhídrico y el cinc y la reacción entre el salfumán (disolución al 20% de ácido clorhídrico) y el papel de aluminio. En ambas reacciones, se produce hidrógeno. Los resultados se pueden ver en este vídeo (la segunda reacción está acelerada al doble ya que tardó casi 2 minutos en producirse).
Con el grupo obtuvimos algunos resultados:
-Comprobamos experimentalmente la definición de reacción química.
-Comprobamos que sustancias parecidas tienen comportamientos parecidos: los metales reaccionan con los ácidos pero no lo hacen a la misma velocidad, por ejemplo.
-Observamos la importancia de la producción de gases por la presión y sus efectos. Esto nos sirvió para comprender la importancia de las medidas de seguridad en el laboratorio.
-Vimos un ejemplo de reacción exotérmica.
Durante el curso 2014/15 dentro de la materia Taller de Ciencias de 1º ESO trabajamos las reacciones químicas, y dentro de ellas, la reacción entre ácidos y metales. Comparamos la reacción entre el ácido clorhídrico y el cinc y la reacción entre el salfumán (disolución al 20% de ácido clorhídrico) y el papel de aluminio. En ambas reacciones, se produce hidrógeno. Los resultados se pueden ver en este vídeo (la segunda reacción está acelerada al doble ya que tardó casi 2 minutos en producirse).
Con el grupo obtuvimos algunos resultados:
-Comprobamos experimentalmente la definición de reacción química.
-Comprobamos que sustancias parecidas tienen comportamientos parecidos: los metales reaccionan con los ácidos pero no lo hacen a la misma velocidad, por ejemplo.
-Observamos la importancia de la producción de gases por la presión y sus efectos. Esto nos sirvió para comprender la importancia de las medidas de seguridad en el laboratorio.
-Vimos un ejemplo de reacción exotérmica.
Con otros niveles más altos se puede trabajar los potenciales redox, la importancia de la concentración de los reactivos, búsqueda de las condiciones de trabajo para cumplir la Ley de la Conservación de la Masa, qué ocurre con los metales nobles y los ácidos,...
El hidrógeno parece ser una de las opciones para un mundo menos contaminado. Por cierto, en esta búsqueda de energía alternativas no podemos olvidarnos de lo que ya tenemos: la Energía Solar. Muchas veces parece que esta opción no acaba de arrancar (¿o no quieren que arranque?...)
Información:
http://culturacientifica.com/2016/02/03/hidrogeno-a-partir-de-cualquier-biomasa/
Imágenes:
www.ecoportal.net
Imágenes:
www.ecoportal.net

No hay comentarios:
Publicar un comentario